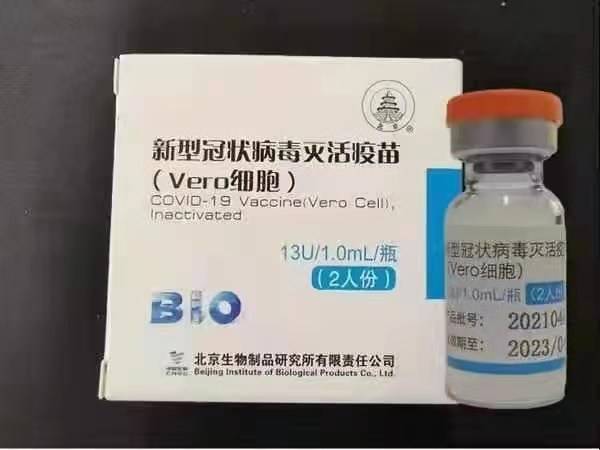
Sinopharm (Pequín): BBIBP-CorV
FASE 1
1 Prova
ChiCTR2000032459
Xina
FASE 2
2 assajos
NCT04962906
Argentina
ChiCTR2000032459
Xina
FASE 3
6 Assajos
NCT04984408
ChiCTR2000034780
Emirats Àrabs Units
NCT04612972
Perú
NCT04510207
Bahrain, Egipte, Jordània, Emirats Àrabs Units
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
Emirats Àrabs Units
Aprovacions
Llista d'ús d'emergència de l'OMS 59 Països
Angola 、 Argentina 、 Bahrain 、 Bangladesh 、 Bielorússia 、 Belize 、 Bolívia (Estat plurinacional) 、 Brasil 、 Brunei Darussalam 、 Cambodja 、 Camerun 、 Txad 、 Xina or Comores 、 Egipte 、 Guinea Equatorial 、 Gabon 、 Gàmbia 、 Geòrgia 、 Guyana 、 Hongria 、 ndones 、 Iran (República Islàmica de) 、 Iraq 、 Jordània 、 Kirguizistan 、 República Democràtica Popular Lao
Líban 、 Malàisia 、 Maldives 、 Mauritània 、 auritius 、 Mongòlia 、 Montenegro 、 Marroc 、 Moçambic 、 Namíbia 、 Nepal 、 Níger 、 Macedònia del Nord 、 Pakistan 、 Paraguai 、 Perú 、 Filipines 、 República del Congo 、 enegal 、 Sèrbia 、 Seychelles 、 Sierra Leone 、 Salomó Illes 、 Somàlia 、 Sri Lanka 、 Tailàndia 、 Trinitat i Tobago 、 Tunísia 、 Emirats Àrabs Units 、 Veneçuela (República Bolivariana de) 、 Viet Nam 、 Zimbabwe
Sinopharm BBIBP-CorV COVID-19 és una vacuna inactivada feta de partícules de virus cultivades en cultiu que no tenen capacitat patògena. Aquest candidat vacuna va ser desenvolupat per Sinopharm Holdings i l'Institut de Productes Biològics de Pequín.
La vacuna Sinopharm BBIBP-CorV funciona permetent al sistema immunitari produir anticossos contra el coronavirus beta SARS-CoV-2. Les vacunes contra virus inactivats s’utilitzen des de fa dècades, com la vacuna contra la ràbia i la vacuna contra l’hepatitis A. Aquesta tecnologia de desenvolupament s’ha aplicat amb èxit a moltes vacunes conegudes, com la vacuna contra la ràbia.
La soca SARS-CoV-2 de Sinopharm (soca WIV04 i número de biblioteca MN996528) es va aïllar d’un pacient a l’hospital Jinyintan de Wuhan, Xina. El virus es va propagar en cultiu en una línia cel·lular Vero competent i el sobrenadant de les cèl·lules infectades es va inactivar amb β-propiolactona (1: 4000 vol / vol, 2 a 8 ° C) durant 48 hores. Després d’aclarir els residus cel·lulars i la ultrafiltració, es va realitzar una segona inactivació de la β-propiolactona en les mateixes condicions que la primera inactivació. Segons l’OMS, la vacuna es va adsorbir sobre 0,5 mg d’alum i es va carregar en xeringues precomplertes en 0,5 ml de solució salina esterilitzada amb tampó fosfat sense conservants.
El 31 de desembre de 2020, l’Administració estatal de medicaments va anunciar l’aprovació de la vacuna experimental desenvolupada per Sinopharm.
El 7 de maig de 2021, l’Organització Mundial de la Salut va anunciar l’aprovació de la vacuna. La llista d’ús d’emergència de l’OMS va permetre als països agilitzar les seves pròpies aprovacions reglamentàries per importar i administrar la vacuna COVID-19. El grup d’experts assessors de l’OMS sobre estratègies de vacunació també ha finalitzat la seva revisió de la vacuna. Segons totes les proves disponibles, l’OMS recomana dues dosis de vacuna, separades entre tres i quatre setmanes, per a adults de 18 anys o més. S’estima que l’eficàcia de la vacuna contra malalties simptomàtiques i hospitalitzades és del 79% per a tots els grups d’edat.
L'American Medical Association va publicar "A Randomized Clinical Trial: Effect of 2 Inactivated SARS-CoV-2 Vacunes on Symptomatic COVID-19 Infection in Adults" el 26 de maig de 2021, concloent que "en aquest anàlisi provisional preespecificat d'un assaig clínic aleatori, adults Les 2 vacunes SARS-CoV-2 inactivades administrades en aquesta anàlisi provisional preespecificada dels assaigs clínics aleatoritzats van reduir significativament el risc de COVID-19 simptomàtic i els esdeveniments adversos greus eren rars ". En aquest assaig aleatori de fase 3 en adults, l'eficàcia de les dues vacunes antivirus inactivades en casos simptomàtics de COVID-19 va ser del 72,8% i del 78,1%, respectivament. 2 vacunes tenien esdeveniments adversos greus poc freqüents amb una freqüència similar al grup de control només amb alum, i la majoria no estaven relacionats amb la vacunació. Una anàlisi exploratòria va trobar que les dues vacunes induïen anticossos neutralitzants mesurables, de manera similar als resultats de l’assaig de fase 1/2.
El grup de treball de l'OMS SAGE va publicar una revisió de la vacuna Sinopharm / BBIBP COVID-19 el 10 de maig de 2021. La vacuna COVID-19 de GAVI incorpora un monitor de vial de vacuna que indica als agents sanitaris si la vacuna s'ha emmagatzemat correctament i no ha estat exposada a sobreescalfament. Com a resultat, es va produir danys, GAVI va informar el 14 de maig de 2021. Les etiquetes intel·ligents fabricades per Zebra Technologies i fabricades per Temptime Corporation, consisteixen en un cercle amb un quadrat de colors més clars al centre, fet d’un producte químic incolor que desenvolupa el color de manera irreversible amb el pas del temps. . Això es fa més fosc per donar una indicació visual de l’exposició acumulada a la calor. Un cop el vial s’ha exposat a la calor més enllà del seu rang d’emmagatzematge òptim, el quadrat es torna més fosc que el cercle, cosa que indica que ja no s’hauria d’utilitzar la vacuna.
Número de registre de la biblioteca nacional de medicaments contra la vacuna BBIBP-CorV COVID-19: DB15807.